近日,我校化学与分子工程学院朱为宏院士、郭志前教授团队在原创性荧光手术导航造影剂领域取得重要研究进展。研究团队创新提出蛋白驱动分子探针重组装策略,发展了针对胆汁特异性激活的新型近红外二区荧光造影剂,相关研究成果以“Protein-Triggered Reassembly of Quinocyanine Nanosheets forIntraoperative NIR-II Cholangiography”在线发表于《德国应用化学》,并被选为Hot Paper。
面向未来,术中导航技术正由“结构可见”向“功能可判”、由“经验依赖”向“精准决策”加速演进。以近红外二区(NIR-II)荧光成像为代表的新一代光学导航手段中凭借更深的组织穿透能力、更低的自发荧光背景和更高的信噪比,有望在复杂解剖结构和高风险手术中实现真正意义上的实时、精细化引导。然而,由于多数组织特异性生物标志物(如受体蛋白)本身缺乏化学反应活性,如何针在特定生理微环境或关键生物分子,发展激活型近红外荧光探针,触发成像信号放大,突破传统依赖高表达受体的成像模式,实现对病灶边界、关键管道及功能组织的高特异性识别,是该领域亟待解决的核心科学问题。
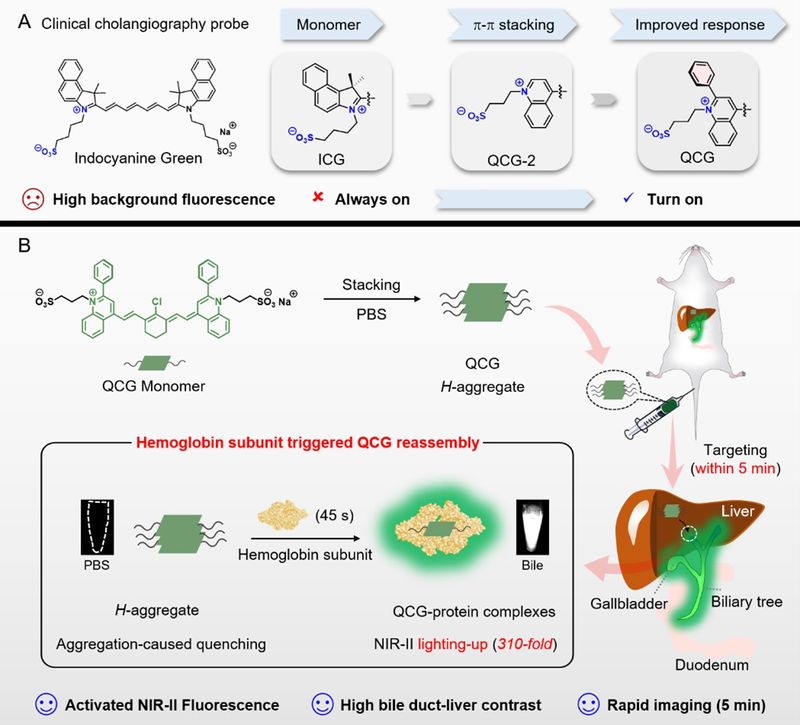
团队创新性提出了由靶标蛋白触发的分子探针原位重组装新策略。该策略基于近红外染料分子平面性强、易发生 π–π 堆积的结构特征,首先将染料预组装为荧光淬灭的纳米聚集体;随后在靶标蛋白特异结合的作用驱动下,初始聚集体发生解离,并进一步重组为热力学上更稳定的染料–蛋白复合物,从而实现“关—开”式的特异性激活信号。研究团队基于分子工程化设计思路,成功构建了胆汁特异性激活的近红外喹啉菁(QCG)荧光成像造影剂,其成像性能显著优于FDA临床批准的胆道造影剂吲哚菁绿(ICG)。
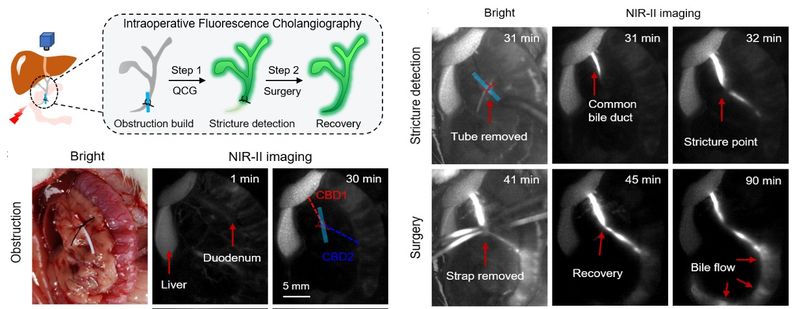
基于蛋白质测序结合透射电子显微镜分析进一步揭示,胆汁中的血红蛋白亚基能够特异性驱动初始片状喹啉菁纳米聚集体发生重构,转变为形貌均一、结构稳定的球形蛋白-染料复合聚集体,并实现在 1011 nm 处高达 310 倍的荧光显著增强。基于喹啉菁探针对胆汁的选择性激活特性,研究团队首次在活体水平实现了肝内胆管结构的清晰可视化,并进一步展现出高对比度、精准的胆管造影能力,涵盖胆道树整体描绘、狭窄部位识别、胆汁渗漏实时检测以及双色肝胆成像等多种关键术中应用场景。该靶标蛋白触发的原位重组装策略为可激活近红外二区荧光探针提供了具有普适性的分子设计范式,为荧光引导手术分子工具箱的拓展奠定了重要基础。
该论文第一作者为化学学院张玉涛特聘副研究员,郭志前教授、徐益生教授为文章通讯作者。研究工作在朱为宏院士和田禾院士的悉心指导下完成,复旦大学法医学与法庭科学学院刘志勇教授以及上海交通大学医学院附属新华医院心胸外科何逸凡等在研究过程中给予了重要支持。该研究获得了国家重点研发计划专项和国家杰出青年科学基金的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202522772






