细胞膜是细胞内外信号及物质传递的重要生物界面,跨膜蛋白受体通过级联反应实现细胞间信号传导,但天然受体功能复杂且难以定向改造。尽管近年来DNA纳米结构为人工受体的设计提供了新思路,但现有人工受体仍面临稳定性不足、功能单一、难以在天然细胞中实现复杂调控等挑战。近日,我校化学与分子工程学院钱若灿副教授与德克萨斯大学奥斯汀分校陆艺(Yi Lu)教授合作,在基于DNA的人工受体构建与可编程细胞信号传导与调控方面取得突破性进展,相关成果以“Synthetic transmembrane DNA receptors enable engineered sensing and actuation”为题发表于Nature Communications。
研究人员设计了一种基于DNA纳米结构的跨膜人工受体系统,实现了细胞表面信号传导和精确的细胞功能调控,为细胞工程与生物传感领域提供了新的策略。跨膜DNA受体由三部分组成:1.胞外信号接收域:通过适配体(aptamer)识别特定膜蛋白(如MUC1、Met);2. 疏水跨膜锚定域:利用C12脂质链将受体稳定锚定在细胞膜上;3. 胞内信号输出域:通过DNAzyme(DNA酶)实现下游基因调控或蛋白表达控制。通过AND/OR逻辑门控机制,受体仅在特定膜蛋白组合存在时激活(如同时识别MUC1和Met触发AND逻辑),实现细胞类型特异性响应。受体二聚化后激活金属离子依赖性DNAzyme,可精准切割PD-L1 mRNA,抑制免疫检查点蛋白表达,显著增强T细胞对癌细胞的杀伤效率。
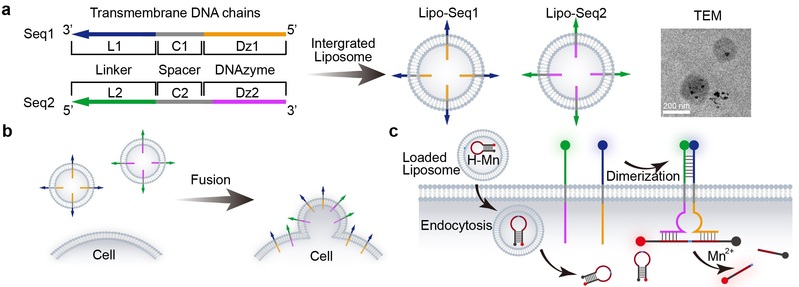
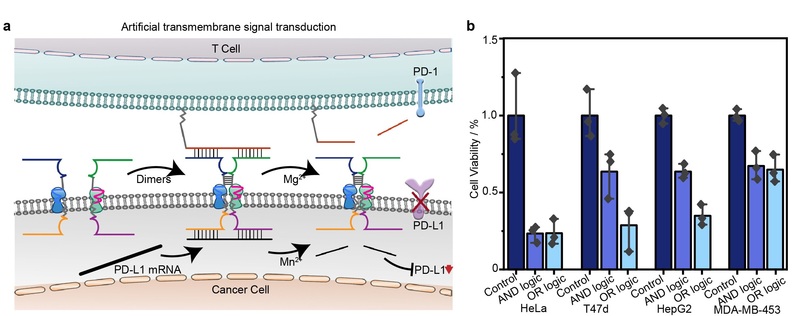
该研究工作由周泽蕊博士在钱若灿副教授和陆艺教授指导下完成。论文的第一作者为周泽蕊,共同通讯作者为钱若灿副教授和陆艺教授。该工作得到了李大伟教授的指导和帮助,并得到了结构可控先进功能材料及其制备教育部重点实验室、费林加诺贝尔奖科学家联合研究中心的支持以及国家自然科学基金、国家科技重大专项、上海市自然科学基金等项目资助。
原文链接:https://www.nature.com/articles/s41467-025-56758-1






