近日,我校材料科学与工程学院李永生教授团队在纳米医学肿瘤治疗领域取得新进展,相关研究成果以“Tumor Microenvironment-Responsive Engineered Hybrid Nanomedicine forPhotodynamic-Immunotherapy via Multi-Pronged Amplification of Reactive Oxygen Species”为题发表在《自然-通讯》(Nature Communications, 2025, 16, 424.)上。
基于活性氧(ROS)的肿瘤疗法,如光动力疗法、声动力疗法、化学动力学疗法等已被广泛研究。然而,细胞内抗氧化应激防御机制由于可减轻肿瘤部位ROS的细胞毒性、帮助肿瘤细胞逃避氧化应激损伤,使ROS基疗法治疗水平大打折扣。近期提出的原位多途径调控ROS策略有望在提高疗效中发挥作用,但肿瘤细胞内、外源ROS调控途径之间往往会相互干扰,且肿瘤微环境(TME)内存在的严重缺氧状态又制约了其疗效的发挥。因此,亟需发展针对肿瘤微环境中不同组分间相互作用的ROS调控策略,以放大肿瘤治疗疗效。成纤维细胞在TME中广泛分布并且伴随癌症的进展会被诱导成激活状态形成癌症相关成纤维细胞(CAFs),活化的CAFs将使肿瘤内部产生高间充质压力,进而压迫肿瘤血管、减少纳米药物渗透并阻碍外部氧气供应导致治疗效果不理想。基于此,研究团队利用TME中的CAFs这一靶点,设计并构建了一种新型TME响应杂化纳米药物(ZnPP@FQOS),其通过“限域”装载原卟啉锌(ZnPP)和槲皮素(Que),可实现CAFs的重塑以及内、外源多途径ROS的调控,进而增强肿瘤治疗效果(图1)。当ZnPP@FQOS经血管渗入TME时,它首先会响应TME的弱酸性pH值从硅基杂化壳层中释放Que,作用于CAFs并将其重塑,为ROS生成提供氧气原料以缓解缺氧且有助于纳米药物渗透。同时,被肿瘤细胞内吞的Que可通过下调凋亡拮抗蛋白Bcl-xL实现细胞凋亡。此外,进入肿瘤细胞后二硫键交联的杂化硅基壳层会响应过量的谷胱甘肽释放ZnPP,从而在激光照射时引发光动力效应产生单线态氧,并通过下调血红素加氧酶1(HO-1)破坏抗氧化应激防御系统,最终实现了内、外源“多管齐下”的ROS调控策略。
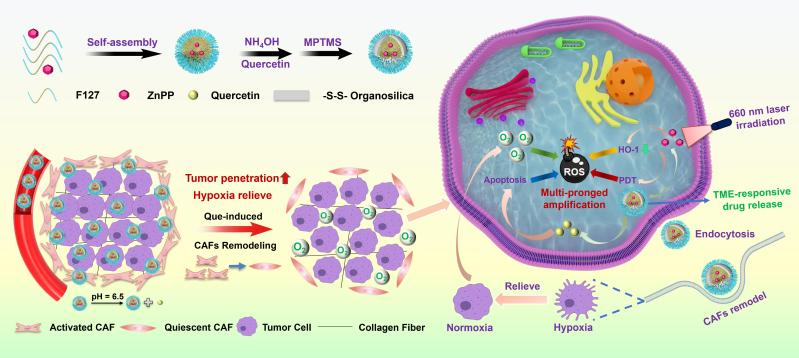
图1. ZnPP@FQOS的制备流程及通过内、外源“多管齐下”ROS调控以提高肿瘤疗效的机理示意图
研究团队进一步在细胞及活体层面分别验证了ZnPP@FQOS的深层组织穿透能力(图2)。细胞层面上构建了肺癌细胞(KP)与CAFs(3T3)共混的多细胞肿瘤球作为体外模型对纳米药物组织渗透能力进行评估,结果表明ZnPP@FQOS在弱酸性条件下能够成功渗入平均直径为120μm的肿瘤球内核,在70μm处有较强荧光分布,具有良好渗透能力。活体层面上对浅层(0mm)以及深层(3mm)的肿瘤组织进行切片,并且对血管进行染色,发现ZnPP@FQOS相较于其他两组药物有明显的深层组织荧光积累及更远的血管渗透距离,说明该纳米药物具有良好的肿瘤组织渗透能力。
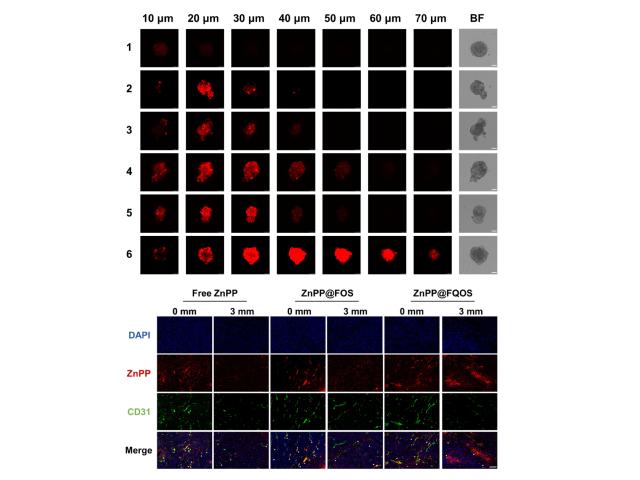
图2. 利用多细胞肿瘤球以及肿瘤组织评估ZnPP@FQOS的组织渗透能力
通过建立荷瘤小鼠模型,研究团队系统探究了ZnPP@FQOS的抑瘤效果及免疫应答激活能力(图3)。基于KP肺癌皮下瘤模型发现其具有显著的抑瘤效果,抑瘤率达到了92.9%;通过对肿瘤内的ROS进行染色成功地在活体层面证明了内、外源“多管齐下”ROS调控策略的成功实现。其次构建了Pan02胰腺癌双侧肿瘤模型进一步验证ZnPP@FQOS联合免疫检查点阻断疗法后的全身性免疫激活效果。结果表明,ZnPP@FQOS治疗后脾脏中的成熟树突状细胞数量得到显著提升,并且原发及远端肿瘤经纳米药物治疗后的细胞毒性T细胞数量均大幅增加,说明其成功激活了小鼠的全身性免疫反应,扭转了胰腺癌的严重抑制免疫微环境。该工作将为设计和精准构建以ROS调控为基础的纳米药物从而实现安全高效的肿瘤治疗提供了新思路。
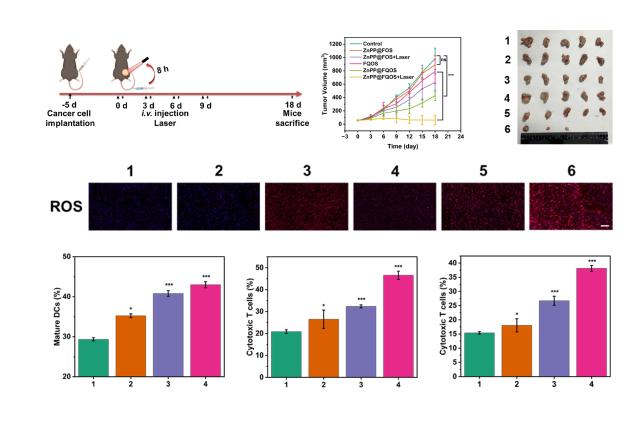
图3. 单侧及双侧皮下肿瘤模型模拟ZnPP@FQOS的抑瘤能力、ROS调控效果以及全身性免疫激活能力
我校材料科学与工程学院博士研究生邹镜霖为论文第一作者,上海市肺科医院姜聪、胡强胜博士为共同第一作者。我校李永生教授、上海市肺科医院张鹏教授为共同通讯作者。该研究工作得到了国家重点研发计划、国家自然科学基金、上海领军人才等项目的支持。
论文链接:https://www.nature.com/articles/s41467-024-55658-0






