近日,我校生物工程学院蔡孟浩课题组在毕赤酵母基因组5’非翻译区(5’UTR)作用规律及调控设计方面取得新进展,通过对工业菌株毕赤酵母基因组的系统分析,发现了编码基因上游5’UTR区的作用规律,并据此设计了一系列合成生物学元件,实现了对蛋白翻译水平的精细调控,相关成果以“Nucleotide Distribution Analysis of 5’UTRs in Genome-Scale Directstheir Redesign and Expression Regulation in Yeast”为题,在线发表于《代谢工程》期刊 (Metabolic Engineering)。
非常规酵母和丝状真菌作为重要的工业菌株,在制药、食品、生物炼制、酶制剂、化学品和生物材料等工业领域得到广泛应用。然而,这些菌株的深度重编程仍然受到遗传背景不清晰和分子工具不足的限制。尽管CRISPR-Cas9衍生技术有效解决了基因编辑问题,但灵活且精确的表达控制仍存在瓶颈限制。近年来,转录调控工具的开发已经极大丰富了真核生物的合成生物学元件库,但关于翻译水平调节的研究却相对很少。该研究提出了一种新策略,通过基于基因组规模的5'UTR核苷酸分布分析及重构设计,以精细调控酵母中的表达调控。
巴斯德毕赤酵母(Komagataella phaffii,也称Pichia pastoris)是一种Crabtree阴性菌株,生长密度高,相比其他酵母,具有较强的蛋白表达能力。通常,细胞的生理特性会随着基因组中不同基因的表达而发生变化。基于该想法,作者探究分析了四种典型性酵母物种毕赤酵母、酿酒酵母、克鲁维酵母及解耶氏酵母的基因组规模5'UTR的核苷酸分布行为,发现了其在不同酵母中呈现不同的作用规律。其中,毕赤酵母的5'UTR中,基因正义链上游的‘G’频率出现了显著下降,推测可能与其强蛋白表达能力的特性相关。基于此,作者通过人工调整5'UTR中的‘G’含量,替换‘G’为其他碱基类型的策略,以此调节基因表达强度。增加‘G’含量通常会降低表达强度,而在-50 ~ -1范围内将‘G’替换为‘A’或‘T’则显著促进了基因在不同启动子下的表达。
同时,作者通过基因组范围内对5'UTR中三核苷酸单元的偏好分析,揭示了5'UTR中的优选三核苷酸单元,其中KZ3(位于‘AUG’上游-3 ~ -1位置)对基因表达起到了主导作用。作者构建了128种KZ3变体,其中58种KZ3变体的基因表达高于天然KZ3序列。将工程化的5'UTR与KZ3重新组合,有效提高了工业蛋白(如β-乳球蛋白、卡拉西纳米单抗和α-淀粉酶)的重组表达能力。同时,通过组合及原位精细调控多酶途径基因表达,有效提升了化工平台化学品3-羟基丙酸的合成能力,实现单基因拷贝菌株以甲醇为碳源的孔板发酵产量达到15.7g/L。这些结果证明了该策略和工具在毕赤酵母中精细调控基因表达的可行性。
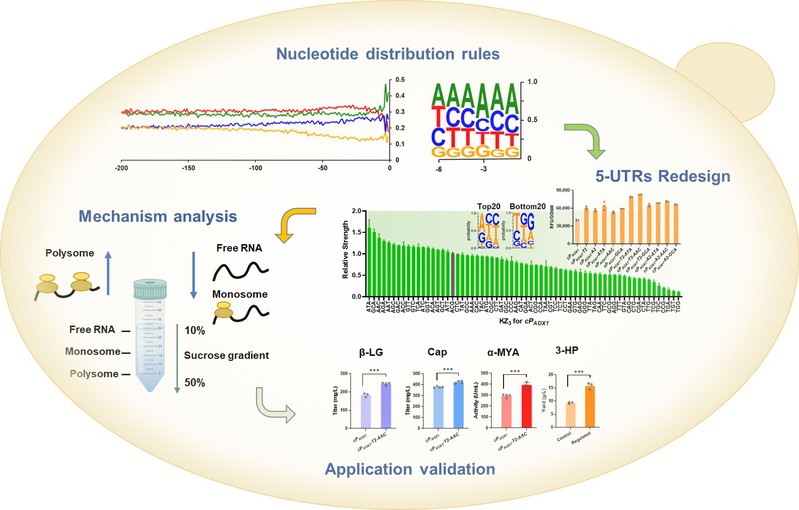
图片说明:毕赤酵母基因组规模5'UTRs碱基分布规律分析及理性调控设计
多核糖体结合分析表明,重构设计的5'UTR-KZ3序列通过招募更多的核糖体到mRNA上来增强翻译水平,而未显著影响基因转录水平。目前,尽管在真核生物(包括酵母)的转录调控方面已有诸多进展,但在翻译调控方面的策略和工具仍然非常有限。本研究提供了一种有效的方法和参考工具,用于真核细胞的翻译调控。研究结果表明,调控翻译起始过程能够通过使用已构建的5'UTR-KZ3变体或在体内原位进行核苷酸编辑,设计5'UTR-KZ3短序列,甚至仅使用KZ3,即可进行基因表达强度的调控。此外,基因组‘NGG’序列分析表明,5'UTR的CRISPR-Cas9可编辑位点广泛分布,这为体内的规模化原位编辑提供了可能。这些调控工具和方法可通过精细调节代谢网络突破蛋白表达的瓶颈及应用于代谢工程,有助于拓展毕赤酵母作为细胞工厂的应用。5'UTR-KZ3元件与现有启动子设计和转录机制的兼容性,也为构建更为复杂的表达系统提供了可能。
本研究的意义不仅局限于毕赤酵母,还为翻译调控提供了适用于其他非模式生物的样本。随着非常规酵母在生物技术应用场景的日益增加,精准的翻译调控方法将进一步提升这些微生物作为细胞工厂的潜力。结合快速发展、成本降低的DNA合成技术,以及高效的无标记基因编辑技术,使得该策略在各种研究和工业场景中具有很好的可行性。基于基因组规模分析和5'UTR元件理性设计所提供的框架,可以作为翻译调控的基础,为代谢工程和合成生物学研究提供新的工具。
该论文第一作者为博士生要超颖,通讯作者为蔡孟浩教授和刘启博士,研究工作得到国家重点研发计划、国家自然科学基金、上海市探索者计划等项目的支持。






