近日,我校药学院赵玉政教授团队与上海交通大学医学院附属仁济医院蒋玉辉研究员团队合作研究,深入解析了营养缺失条件下PHGDH通过核易位以及酶活转变调控细胞核NAD+和肿瘤细胞生长的分子机制。该研究成果以“The alternative activity of nuclear PHGDH contributes totumor growth under nutrient stress”为题,在线发表在国际权威学术期刊《自然-代谢》上。另外,在白血病研究方面,赵玉政教授与上海交通大学医学院郑俊克研究员、复旦大学生物医学研究院卢智刚研究员、同济大学医学院徐俊教授团队合作研究,揭示了氧化磷酸化在B细胞急性淋巴细胞白血病的关键作用。该研究成果以“Oxidativephosphorylation enhances the leukemogenic capacity and resistance tochemotherapy of B cell acute lymphoblastic leukemia”为题,在线发表在国际权威学术期刊《科学-进展》上。
许多研究表明,在不同的营养状态下代谢酶表达水平、亚细胞定位以及酶活的改变,能够使代谢酶以精确而有效的方式调控细胞信号传导和基因表达等生理活动。然而,代谢酶相关的生理调节作用基本上可以归因于代谢产物的生成,其中,代谢产物可以为蛋白质或染色质修饰反应提供“燃料”。3-磷酸甘油酸脱氢酶(PHGDH)是丝氨酸合成途径的第一个限速酶,主要负责将糖酵解中间产物3-磷酸甘油酸(3-PG)转化为3-磷酸羟基丙酮酸(3-PHP),最终进入一碳循环,从而维持相应的物质稳态。
该研究发现,在葡萄糖正常或缺失培养条件下,向细胞补充外源性的丝氨酸也都不能有效回补PHGDH缺失对细胞生长造成的损伤,这表明PHGDH具有更广泛而未知的生理作用。研究人员进一步研究发现,葡萄糖缺失条件下,PHGDH Ser371被p38 MAPK磷酸化,促使胞质定位的PHGDH转位到细胞核,而阻碍PHGDH的入核抑制了该条件下肿瘤细胞的生长(图1)。蛋白质谱分析结果表明,葡萄糖缺失条件下AMPK介导了PHGDH Ser55磷酸化,而此磷酸化显著增强了PHGDH对底物malate而不是3-PG及2-HG氧化的催化活性,促进了NAD+向NADH的还原生成(图1)。
针对细胞内核心代谢物NAD(P)(H)等,近几年,赵玉政教授和杨弋教授团队合作研发了系列原创性、高性能的遗传编码荧光探针,如NADH探针SoNar/Frex、NAD+探针FiNad和NADPH探针iNap等,并建立了“高通量”与“全景式”活细胞代谢监测分析方法,被国际同行称赞为“颠覆性”技术,系列研究成果9次发表在国际权威学术期刊上,包括Nature Methods(2017)、Nature Metabolism(2021)、Nature Protocols(2018;2016)、CellMetabolism(2019;2015;2011)、Developmental Cell(2020)、Science Advances(2021)等。为了检测活细胞内NAD+/NADH 比率和NAD+水平,研究人员将SoNar和FiNad探针标记细胞核特异性信号肽,以便更好地探究NAD+或NADH在哺乳动物细胞中的核分布,他们惊奇地发现,葡萄糖缺失条件下,阻碍PHGDH的细胞核转运也导致了细胞核内NAD+水平的上升(图1)。

图1:葡萄糖缺失条件下PHGDH通过调控细胞核NAD+影响肿瘤细胞生长
在临床胰腺癌样本中,PHGDHSer371和Ser55磷酸化水平分别与p38和AMPK激酶活性呈正相关。在生理功能方面,营养应激下细胞核内的PHGDH通过其介导苹果酸氧化催化功能调控c-Jun转录活性从而维持了肿瘤细胞生长和肿瘤发展。此研究阐明了PHGDH非典型代谢活性调控肿瘤生长的分子机制,并阐释了其酶活的改变在肿瘤发生中的功能意义,这将为肿瘤治疗新策略的开发提供新思路。
我校药学院赵玉政教授和上海交通大学医学院附属仁济医院蒋玉辉研究员为本文的共同通讯作者。上海市第一人民医院马春敏博士、上海交通大学医学院博士研究生郑珂和我校药学院博士研究生姜坤为本文共同第一作者。相关研究工作得到了国家自然科学基金委、国家重点研发计划、上海市细胞代谢光遗传学技术前沿科学研究基地和中国医学科学院创新单位等项目资金的支持。
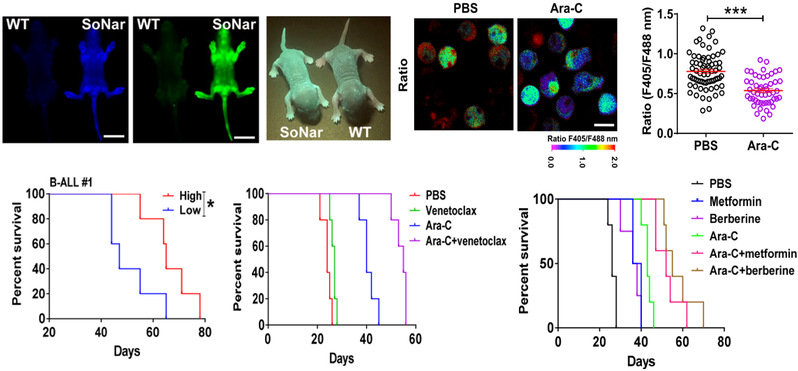
图2:代谢成像揭示B细胞急性淋巴细胞白血病代谢特征与耐药性
B细胞急性淋巴细胞白血病(B-ALL)是一种严重的恶性造血疾病,会引起造血干/祖细胞的克隆扩增,这种现象通常发生在儿童或青少年中。目前,化疗、骨髓移植、CAR-T治疗等可在B-ALL的治疗中取得较好的效果。然而,这些治疗方案的有效性受到耐药性、缺乏主要的组织相容性复合物匹配的供体造血干细胞来源,以及患者无反应性或CAR-T治疗引起的毒性等众多因素的影响。尽管化疗被认为是B-ALL治疗的最有效方法之一,但使用阿糖胞苷(Ara-C)等化疗药物治疗后,仍有20%的患者复发。越来越多的证据表明,小部分称为白血病起始细胞(LIC)可能会导致耐药性或白血病复发。最近研究发现,新陈代谢状态在许多不同类型癌症的发生发展中起关键作用,然而,不同营养物质的独特代谢如何促进B-ALL细胞的耐药性仍有待进一步研究。
研究人员利用遗传编码NADH/NAD+探针SoNar的转基因工具鼠,发现B-ALL细胞主要以氧化磷酸化作为其主要能源(图2)。SoNar低的B-ALL细胞具有增强的线粒体呼吸能力,倾向于驻留在血管壁中,并且比SoNar高的细胞中的功能性白血病起始细胞富集更多。SoNar低的细胞比SoNar高的细胞对B-ALL一线用药Ara-C具有更高抵抗力。临床样本中,SoNar低的人原代B-ALL细胞也偏爱氧化磷酸化,并且对Ara-C处理有抵抗力。用3种药物(维奈托克、二甲双胍、小檗碱)抑制氧化磷酸化作用,无论在体内还是体外,都能很好减弱Ara-C诱导的耐药性(图2)。本研究为理解代谢特性与B-ALL细胞的命运决定之间的潜在联系以及开发针对癌症耐药性的治疗策略提供了有效的工具和独特的视角。目前,针对B细胞急性淋巴细胞白血病的联合用药方案,我校以第一单位已申请国家发明专利(专利名称:癌症治疗靶点及其用途,申请号:202110262093.5)。
上海交通大学医学院郑俊克研究员、复旦大学生物医学研究院卢智刚研究员、我校药学院赵玉政教授和同济大学医学院徐俊教授为本文共同通讯作者。相关研究工作得到了国家自然科学基金委、国家重点研发计划和中国医学科学院创新单位等项目资金的支持。
论文链接:https://www.nature.com/articles/s42255-021-00456-x;https://www.science.org/doi/10.1126/sciadv.abd6280






