近日,我校生物反应器工程国家重点实验室和光遗传学与合成生物学交叉学科研究中心杨弋教授团队,在国际权威学术期刊Nature Communications发表了题为“A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice”的研究论文,报道一种新型基因表达调控技术,可脉冲式激活哺乳动物细胞和小鼠体内的基因表达。

近年来,科研人员已经在包括细胞应激反应、信号传导和发育等多种细胞生命过程中发现基因的脉冲震荡表达,一旦表达失调便会引起细胞代谢的紊乱与疾病的发生。然而,大多数脉冲震荡系统的调控机制和功能仍不清楚,其中一个关键的限制是缺乏能在体外和体内对基因的脉冲震荡表达进行精密控制的技术。为了解决这一技术难题,科研人员开发了系列光控基因表达系统,通过改变光照条件实现基因的脉冲震荡表达。然而,光在深层活体组织中穿透能力偏弱的缺点限制了这些系统在活体中的应用。因此,发展通用型的活体脉冲激活基因表达调控技术十分必要且紧迫。
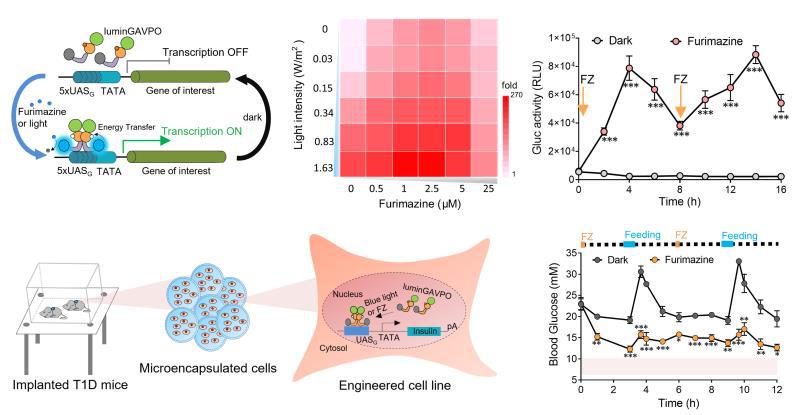
在这项工作中,研究团队创新发展了一种基于BRET(生物发光能量共振转移)的LuminON哺乳动物细胞基因表达调控系统。在该系统中,光敏元件中的荧光素酶催化底物furimazine发出460 nm波长的蓝光,通过分子内的能量转移激活光敏元件,进而启动目的基因的转录与表达。研究结果表明,LuminON系统可以同时响应生物发光和外置蓝光。增加底物浓度或增强光照强度均可显著提高目的基因的表达水平,为不同的应用场景提供非常灵活的选择性。进一步的研究结果表明,LuminON系统对基因表达的激活是脉冲式的,且脉冲的幅度和周期均可通过furimazine底物的剂量进行精确控制。除了培养的细胞,LuminON系统同样可以实现小鼠体内基因表达的脉冲式反复激活。最后,研究团队利用LuminON系统调控胰岛素的脉冲式表达,可以很好地控制I型糖尿病小鼠餐后的血糖稳态。
该项工作是杨弋教授团队与华东师范大学生命科学学院叶海峰教授共同完成。我校李婷博士和陈显军副研究员为本论文的共同第一作者,杨弋教授和叶海峰教授为通讯作者。研究工作得到国家重点研发计划、国家自然科学基金、上海市科委合成生物学项目、“111”计划、生物反应器工程国家重点实验室基金、教育部基本科研业务费、中国博士后科学基金等经费资助。
值得指出的是,在过去一年里,该团队在基因表达调控新技术领域取得了一系列重要研究进展。除了LuminON系统外,还发展了简单、高效的eLightOn光激活基因表达系统,实现了细菌基因表达的直接定量控制(Nucleic Acids Research 2020,48, e33)。药学院高峰教授课题组与之合作,利用智能纳米递药系统实现肿瘤光控基因精准治疗(Acta Pharmaceutica Sinica. B 2020, 10, 1741-1753; J Control Release, 2020, 31:1-14; Molecular pharmaceutics 2020, 17, 301-315)。该团队创新发展的这些新型光遗传学工具不仅为人们更好地理解基因功能和调控网络提供创新性的研究手段,也为基于精准的基因治疗或细胞治疗提供极具价值的工具。
原文链接:https://www.nature.com/articles/s41467-021-20913-1。






