最近,我校药学院高峰教授和杨弋教授团队合作开发了一种新型纳米递药系统,能够响应肿瘤微环境智能释药,联合基因光控表达系统,实现了白喉毒素A片段(DTA)光控与靶向治疗黑色素瘤和乳腺癌,相关成果发表在医学杂志Journal of Controlled Release与Acta Pharmaceutica Sinica B上。
杨弋团队利用一种简单高效的光控基因表达系统(简称:LightOn系统),实现了细胞内具有高效杀伤细胞作用的DTA的可控表达。而设计能够深入肿瘤微环境针对肿瘤细胞发挥特异性杀伤作用的纳米递药系统,克服诸多屏障实现有效转染,是将白喉毒素-LightOn系统应用于治疗肿瘤的关键。
在此基础上,高峰团队设计构建了一种集透明质酸酶(HAase)敏感、谷胱甘肽(GSH)还原敏感、多重靶向、体内长循环为一体的智能纳米递药系统,联合LightOn系统成功应用于多种癌症精准治疗中。研究人员巧妙地设计了GSH还原敏感的VES-SS-PEI阳离子两亲性载体材料,作为内核胶束吸附基因,以及靶向肿瘤部分新生血管细胞和癌细胞的水溶性载体材料HA-PEG-RGD,形成功能性外壳包覆内核胶束。纳米粒经尾静脉注射进入荷瘤小鼠,由于EPR效应被动蓄积到肿瘤部位,通过纳米粒外壳上HA与RGD分别主动靶向CD44受体及αvβ3整合素高表达的癌细胞而被摄取,随后,纳米粒外壳层经过肿瘤内透明质酸酶降解暴露出内核胶束。内核胶束通过溶酶体逃逸进入细胞质中,并受到细胞内较高浓度GSH响应降解,迅速释放光控白喉毒素光控基因(pGDTA),实现癌细胞的有效转染,通过蓝光照射,pGDTA中的pGAVPO基因形成同源二聚体,随后与pU5-DTA基因结合上游的UASG序列结合,激活DTA表达,从而杀伤癌细胞。纳米粒并通过RGD靶向肿瘤部位高表达αvβ3受体的新生血管,从而减少新生血管数量,抑制肿瘤转移。由于光控基因表达系统具有良好的时空可控能力,同时借助纳米递药系统,减少了DTA在正常组织中的表达,在保证最大化抗癌效果的同时最大限度降低毒副作用。相关研究融合了纳米技术与光控基因表达技术,为光控基因表达系统联合纳米递药系统在肿瘤治疗领域的应用研究提供了新思路和科学依据。
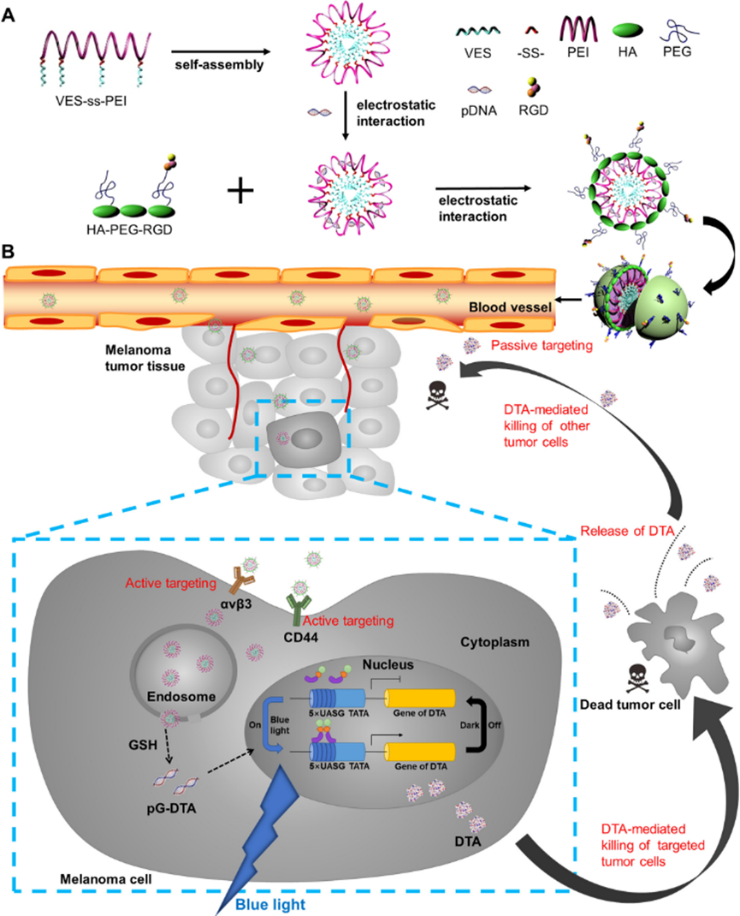
该治疗系统对荷黑色素瘤小鼠具有明显的治疗效果,21天后存活率显著提高,全身毒性降低,结果表明,白喉毒素-LightOn与纳米递药系统相结合,在恶性肿瘤的基因治疗中具有巨大潜力。相关成果以“Spatiotemporally controllablediphtheria toxin expression using a light-switchable transgene system combiningmultifunctional nanoparticle delivery system for targeted melanoma therapy”为题,发表在医学杂志Journal of Controlled Release上(J Control Release, 2020, 319(10):1-14)。
研究团队对智能纳米递药系统以及光控系统进行考察优化,阐明了纳米粒在体内外的智能释药机理以及高靶向特性,发现其能有效抑制乳腺癌生长并抑制肿瘤转移,相关成果以“A combination of LightOn geneexpression system and tumor microenvironment-responsive nanoparticle deliverysystem for targeted breast cancer therapy”为题,发表在医学杂志Acta Pharmaceutica Sinica B上(ACTA Pharm Sin B, 2020, 10(11): 1741-1753)。
上述工作主要由博士后贺牧野和博士研究生侯昕宇等完成,并得到了高峰与杨弋团队的悉心指导。该研究成果得到了上海市自然科学基金项目资金的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0168365919307345
https://www.sciencedirect.com/science/article/pii/S2211383520305542






