高效生物传感与检测作为一种关键平台技术,对反应器发酵过程放大和高通量筛选平台搭建并最终实现绿色智能制造具有重要的意义。围绕这一目标,生物反应器工程国重室主任张立新教授团队利用团队前期开发的细菌别构转录因子(allosteric transcription factors, aTF) 和CRISPR/Cas12a建立了新一代小分子传感和检测平台,简称CaT-Smelor (CRISPR/Cas12a-and aTF-mediated small molecule detector,猫嗅)。该技术不仅既能实现复杂发酵培养液的快速灵敏检测,也可用于临床疾病标志物和目标代谢产物的精确定量分析。相关研究论文“A CRISPR-Cas12a-derived biosensing platform for the highly sensitivedetection of diverse small molecules”于8月14日在Nature Communications期刊发表 。

CRISPR/Cas12a于2015年首次被Zhang Feng课题组开发成基因编辑工具。因Cas12a相比Cas9更具优势,自报道后就迅速受到研究者的关注。2018年4月,Science和Cell Research期刊同时报道了CRISPR/Cas12a的反式切割(trans cleavage)活性,即Cas12a的双链DNA切割活性一经激活之后,就可以极高的活性切割任意序列的单链DNA。利用这一特性,CRISPR/Cas12a随后被开发成高灵敏度核酸检测工具,用于临床诊断病毒DNA大分子。为了建立一种特异、灵敏、简便的高通量并且低成本的小分子/代谢物检测平台,受上述工作的启发,团队通过研发并建成了CaT-Smelor平台。
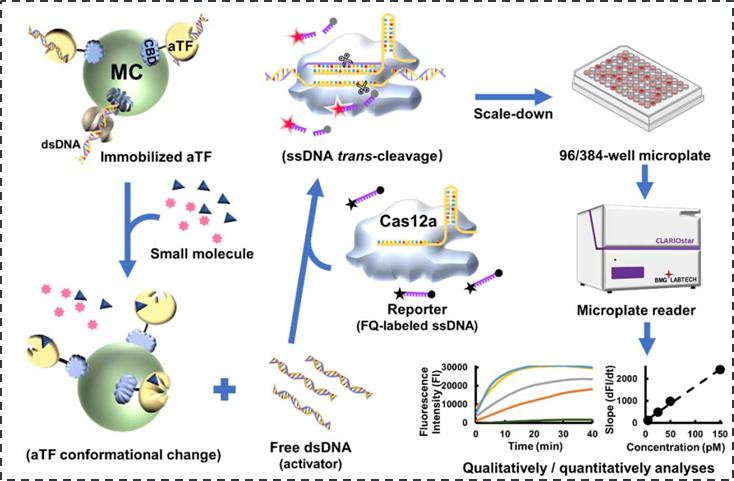
如图所示,CaT-Smelor利用蛋白质固定化技术,将具有DNA结合活性的aTF固定在微晶纤维素颗粒上。当目标小分子出现时,aTF会因小分子诱导而发生构象改变进而降低其与DNA的结合活性,使DNA从aTF上游离出来。通过序列设计,游离的DNA分子可以激活CRISPR/Cas12a的反式切割活性,导致单链荧光探针被切割而产生荧光。最后,通过检测和分析荧光信号就可以实现目标小分子的检测。研究发现,CaT-Smelor可在微孔板中实现对微量血液、发酵液等样品中的目标小分子(例如尿酸、对羟基苯甲酸、四环素)的快速定性和定量检测,检测灵敏度均达到纳摩尔水平。该方法不仅成本低廉,相对传统检测技术也有明显的优势。后续在疾病诊断、代谢物检测以及便携式检测设备开发中具有极大的应用潜力。
安徽大学和华东理工大学联合培养的硕士生梁敏东,中国科学院微生物所的李子龙、王为善博士,以及中国科学院深圳先进技术研究院和华东理工大学联合培养博士后刘家坤为本文的共同第一作者。通讯作者是我校国重室主任张立新教授和国重室固定成员谭高翼副研究员。我校国重室为第一单位和唯一通讯单位。该工作受到了国家自然科学基金委和山东省自然科学基金的支持。
原文链接:https://www.nature.com/articles/s41467-019-11648-1。






