近日,我校药学院郑军教授在ACSCatalysis发表了题为“Zwitterionic π‑Allyl-Pd Species Enabled [2σ+2π]Cycloaddition Reactions of Vinylbicyclo[1.1.0]butanes (VBCBs) with Alkenes,Carbonyls, and Imines”的研究成果。该工作开发了烯基双环[1.1.0]丁烷(VBCBs)作为一种通用的合成子,应用于钯催化的[2s+2p]环加成反应,成功实现了与多种2p体系(包括烯烃、醛、酮和亚胺)的环加成反应,多样性地合成了具有潜在药用价值的全碳、氮杂和氧杂环双环[2.1.1]己烷骨架,为进一步新药研发中的苯环生物电子等排体提供了新的合成策略。
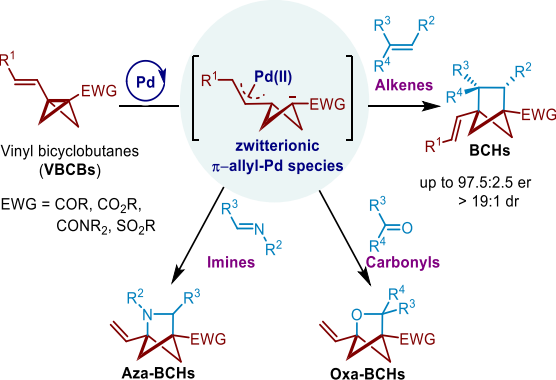
近年来,在“逃离平面”的概念下,饱和桥环化合物在药物化学中受到越来越多的关注,作为取代芳烃的含高Fsp3的生物电子等排体,可用于增强药物候选物的理化和药代动力学性质。同时,这种构象刚性的结构也为潜在的新药研发提供了新的3D环状骨架。目前,包括双环[1.1.1]戊烷(BCPs)、双环[2.1.1]己烷(BCHs)和双环[3.1.1]庚烷(BCHeps)在内的几种桥环骨架已被开发应用。进一步研究表明,在BCH和BCHep骨架中引入氮和氧等杂原子有利于提高水溶性和代谢稳定性,但其通常包含立体中心,这可能导致药物候选物表现出不同的生物活性,因此需要更有效的方法来构建立体中心和饱和桥环骨架。
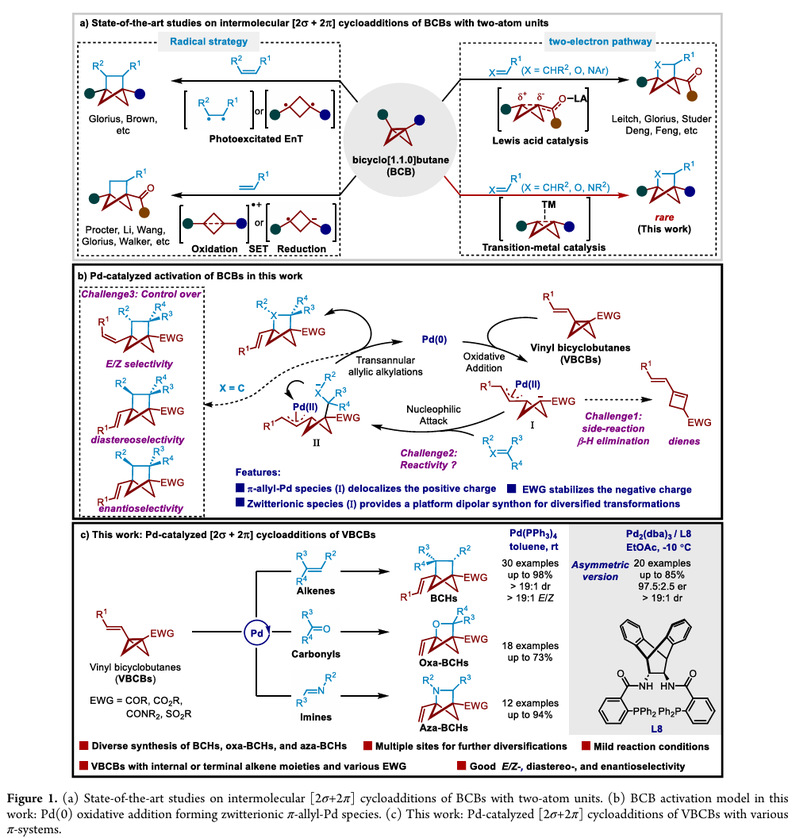
双环[1.1.0]丁烷(BCBs)由于其桥头C - C键的多样反应性一直受到合成化学家的关注。其与多种合成子的环加成反应已然成为一条合成双环[n.1.1]烷烃的简洁高效的方法,包括与卡宾的(3 + 1)环化反应合成BCPs和与环丙烷的(3 + 3)环加成反应合成BCHeps。此外,BCBs与不饱和体系的[2s+2p]环加成反应是构建BCHs的重要策略,已有的报道主要采用如下三种活化策略:能量转移过程的光环加成反应、单电子转移过程的自由基环化反应以及Lewis 酸催化的偶极环加成反应(Figure 1A)。前两种策略会产生自由基物种,这限制了底物的兼容性。后者可以与各种体系如烯烃、醛、烯酮和吲哚进行环加成反应。然而它仅限于含有羰基的BCB底物。过渡金属催化由于其广泛的应用范围和便捷性,是现代有机合成的基本合成工具之一。然而,由于其催化过程中可能会形成金属卡宾物种或者发生其他开环反应,因此将过渡金属催化活化BCB策略应用于这些桥环化合物的构建具有挑战性。
图片来源:ACS Catal.
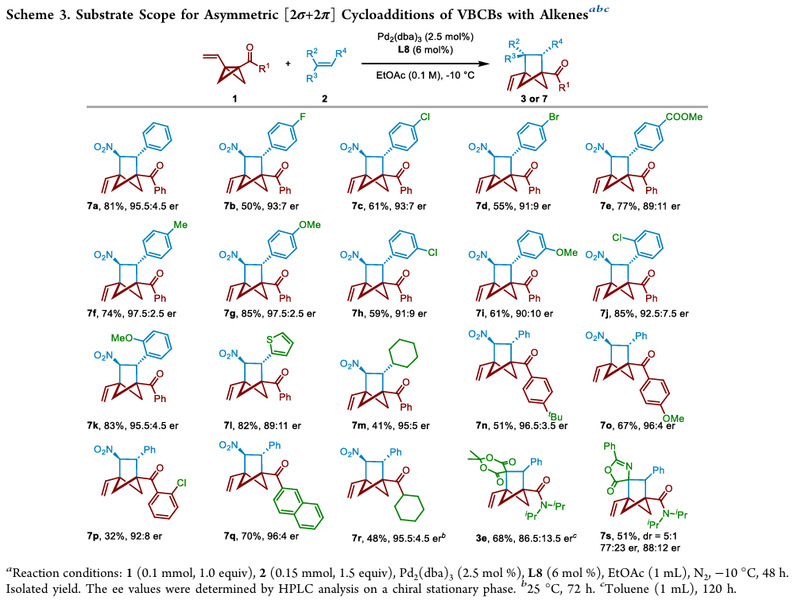
针对上述挑战,团队基于对扩展BCBs的新反应性的兴趣,在前期的工作基础(JACS, 2024, 146, 18565; OL, 2024,26, 1745)上,同时结合乙烯基环丙烷在钯催化环加成反应的文献报道,设计合成了烯基双环[1.1.0]丁烷(VBCB),并应用于钯催化的[2s+2p]环加成反应,实现了双环[2.1.1]己烷骨架的多样性合成 (Figure 1C)。进一步采用手性Trost配体成功实现了钯催化的VBCB与硝基烯烃的不对称[2s+2p]环加成反应,以高非对映选择性和对映选择性合成了具有两个相邻手性中心的多取代双环[2.1.1]己烷。(Scheme 3)
图片来源:ACS Catal.
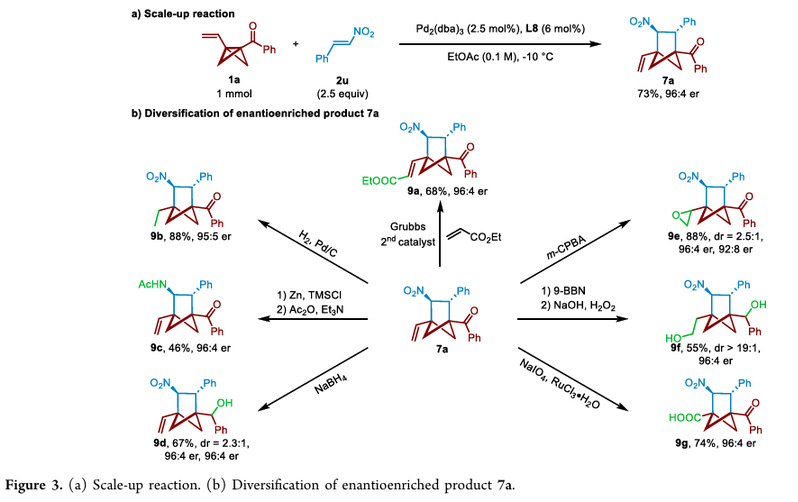
成功实现了手性BCH 7a的放大合成,收率、对映选择性和非对映选择性没有降低。对7a进行了多种转化,包括烯烃复分解反应、还原反应、硼氢化反应、环氧化反应和氧化双键裂解反应等,展示了产物的多功能性。(Figure 3)
图片来源:ACS Catal.
硕士研究生李天翔为该论文的第一作者,郑军教授为该论文的通讯作者。该研究工作得到了国家自然科学基金、上海市科委等经费资助。
原文链接:https://pubs.acs.org/doi/10.1021/acscatal.4c06660
