近日,我校药学院黄瑾课题组在国际权威学术期刊Nature Communications发表题为“PPIA dictates NRF2 stability to promote lung cancer progression”的研究论文,报道了PPIA是维持NRF2蛋白稳定性的关键伴侣蛋白,破坏PPIA/NRF2互作可导致NRF2蛋白水平下调,证明了PPIA/NRF2互作具有明确的可靶向性,是潜在的抗肺癌药物新靶标。

肺癌是所有恶性肿瘤中发病率及死亡率最高的类型,严重危害人类健康,现有疗法虽取得一定程度的临床益处,但治疗效果仍十分有限,迫切需要开发新的治疗策略。核因子E2相关因子2(NRF2)信号通路的过度活化是肺癌的重要驱动因素之一;在肺腺癌中,大概25%的突变均可以使得NRF2蛋白过度积累,导致NRF2信号通路的过度活化;NRF2过度活化可引发肿瘤细胞代谢重编程,通过增强G6PD、IDH1、MTHFD2、GCL等代谢酶的转录过程上调谷氨酰胺代谢及核苷酸合成速度,加快肿瘤细胞的增殖,促使肿瘤恶化;然而,目前尚无有效抑制NRF2信号通路的抗肿瘤靶向治疗策略,鉴于此,寻找抑制NRF2蛋白过度积累的策略一直是肿瘤研究领域备受关注的问题之一。
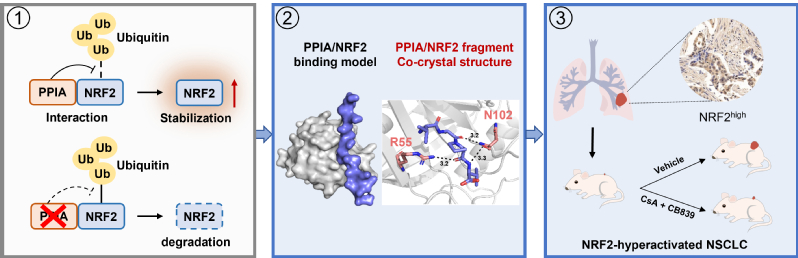
本研究通过Co-IP、Pulldown等实验首次发现了NRF2的关键互作蛋白PPIA,通过二维溶液核磁及复合物晶体结构解析等技术,发现PPIA通过顺反异构作用,将NRF2功能核心区域的174位脯氨酸牢牢锁定在反式构象,极大增强了NRF2蛋白的稳定性,导致其在肺癌细胞中异常积累,驱动肺癌的恶性进展。
此外,本研究发现多肽类PPIA抑制剂CsA可以破坏PPIA/NRF2相互作用、增强NRF2泛素化-蛋白酶体降解,导致NRF2蛋白含量减少。通过克隆形成实验、肺癌原位瘤小鼠模型、PDX模型等实验发现:CsA与谷氨酰胺酶抑制剂CB839联用可以同时下调细胞内NRF2的蛋白含量与谷氨酰胺的代谢水平,表现出显著的协同抗癌效果。

综上,本研究首次发现NRF2的全新相互作用蛋白PPIA,揭示了PPIA稳定NRF2蛋白的机制,提出了靶向干预PPIA/NRF2互作可作为治疗NRF2过度活化肺癌的潜在策略,为后续开发治疗NRF2过度活化的肺癌靶向策略提供了新思路。
该研究工作得到了国家自然科学基金、上海市科学技术委员会、上海市细胞代谢光遗传学技术前沿科学研究基地等科研项目资助。
原文链接:https://www.nature.com/articles/s41467-024-48364-4。
