6月5日,生物技术领域国际顶级权威期刊《自然-生物技术》以长文在线报道了华东理工大学生物反应器工程国家重点实验室张立新/谭高翼团队在血红素及卟啉化合物高效生物制造方向上的突破性进展。研究论文题目为“代谢工程结合生物催化实现卟啉高效合成”。这项研究标志着华东理工大学在卟啉类产品的高效生物制造方面已达到国际领先并具备产业化的水平,未来或将变革或重塑整个卟啉制造工业。

本研究创造性地利用光合细菌Rhodobacter sphaeroides作为底盘微生物,构建高效细胞工厂,并通过偶联酶催化生产卟啉化合物的策略。首先,基于CRISPRi的关键基因筛选和调控双组分系统prrAB磷酸化水平的方法,结合分批补料发酵,在5L反应器中使目标卟啉中间体CPIII的产量达到16.5 g/L;随后设计开发了基于CRISPR/Cas12a的高通量酶筛选平台获得高效的酶催化元件,实现了CPIII的高效酶促转化,合成了各种金属卟啉,包括具有抗肿瘤活性的Zn-CPIII和具有多种功能和用途的血红素。本研究还进一步在200L反应器中实现CPIII的中试放大,并建立了基于重结晶的CPIII纯化工艺,产物纯度超过95%,回收率接近90%。在5L反应器中通过酶催化放大合成血红素和锌卟啉,产量分别达到10.8 g/L和21.3 g/L,均为迄今报道的最高生产水平。技术经济分析(Techno-economic Analysis)表明,大规模生产CPIII和血红素具有显著的成本和制造优势。这项研究提供了高效合成卟啉类产物的解决方案,为大规模生产血红素和其他具有重要工业和医学应用的有价值的卟啉提供了全新的路线,有望重塑卟啉制造工业。
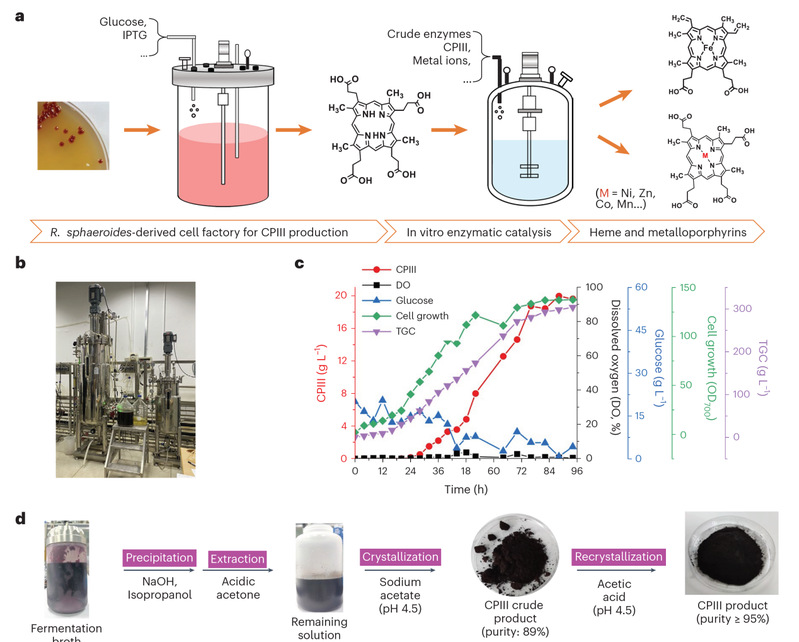
值得一提的是,酶催化在血红素合成过程中扮演着不可或缺的角色,如何获得能高效将CPIII转化为血红素的脱羧酶是本研究需要解决的关键难题。基于张立新/谭高翼团队在2019年最早提出的利用CRISPR/Cas12a和别构转录因子进行高通量检测小分子的CAT-SMELOR(猫嗅)策略(Liang, etal. Nat Commu. 2019. 10:3672),本研究利用链霉亲和素-生物素系统,将能够感应血红素的别构转录因子HrtR固定化在96孔板上,再结合CRISPR/Cas12a的高效核酸检测能力,建成了ELISA-like CAT-SMELOR(简称E-CAT-SMELOR,因操作过程类似ELISA而得名),实现了血红素的高通量检测。结合突变筛选,最终获得高活性的脱羧酶,实现了血红素的高效合成。这也是首次将CRISPR/Cas12a用于酶的高通量筛选,对酶工程具有很好的示范作用。
论文链接:https://www.nature.com/articles/s41587-024-02267-3
