近日,我校谢贺新教授课题组在用于肿瘤治疗的光敏剂研究方面取得了重要进展,发展出了一种新型酶激活富集型近红外光敏剂设计策略,实现了光敏剂在肿瘤细胞中的靶向激活与高效富集。相关成果以“Enzyme-Activatable Near-Infrared Photosensitizerwith High Enrichment in Tumor Cells Based on a Multi-effect Design”为题在线发表于Angew. Chem. Int. Ed.(Angew. Chem. Int. Ed.,DOI:10.1002/anie.202317773)上。
光动力治疗(PDT)主要是通过光敏剂在特定波长光激发下在病变组织中产生高毒性活性氧(ROS)而诱导肿瘤细胞死亡,目前已成为临床肿瘤治疗的一个重要方法。然而,在活体中将光敏剂选择性输送到肿瘤组织并使其有效保留甚至高效富集仍然面临诸多挑战。
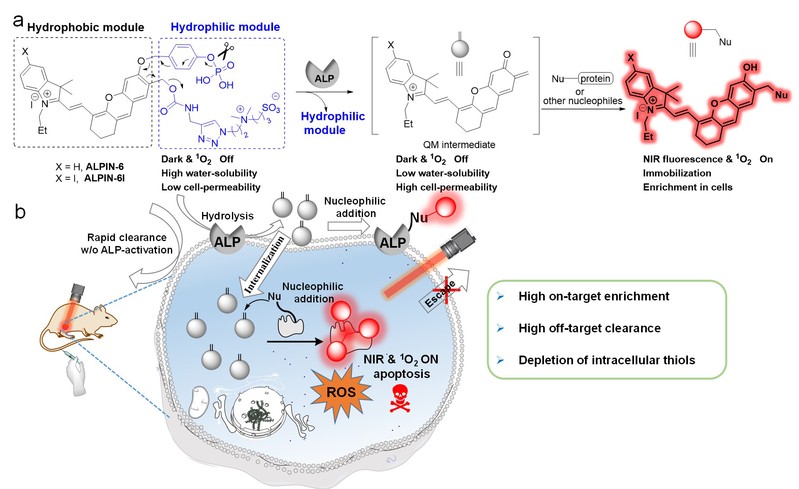
为了解决上述科学问题,研究团队在前期亚甲基苯醌自锚定探针设计的基础上(Chem. Sci. 2020, 5889, Anal. Chem. 2020, 15017),进一步引入多重效果设计,使光敏剂能够在肿瘤组织高表达的碱性磷酸酶作用下同时实现亲水-亲酯转变、共价键锚定和光敏性能开启等三重变化,最终实现在肿瘤组织中的高度富集和光敏功能开启。实验表明,基于这一光敏剂的光动力治疗可实现对小鼠肿瘤组织的完全清除,同时所有测试小鼠都恢复健康。该研究为解决激活型光敏剂和荧光探针分子在活体应用中的挑战提供了一种新思路。
我校博士后李玉姚为论文的第一作者,谢贺新教授为通讯作者。研究工作得到了国家自然科学基金、中国博士后科学基金、上海市细胞代谢光遗传学技术前沿科学研究基地、中央高校基本科研业务费等项目的资助。
