近日,我校化学与分子工程学院,费林加诺贝尔奖科学家联合研究中心田禾院士、贺晓鹏教授团队与海军军医大学附属上海东方肝胆外科医院王红阳院士团队合作发展了一种蛋白质正交化学修饰策略,通过协同靶向癌细胞表面抗原与抑制巨噬细胞吞噬,实现了原发性肝癌的精准可视化及光驱动治疗,相关成果发表于《美国化学会志》(J. Am. Chem. Soc. 2023, 10.1021/jacs.3c05052)。
肝细胞癌(HCC)是临床最常见的原发性肝癌类型,由于肿瘤的高异质性和早期血液标志物的缺乏,HCC的5年总生存率低于20%,并已成为全球死亡率第二高的癌症。目前,手术切除仍然是HCC的首选治疗方案,但仅适用于偏早期且未发生大面积转移的HCC患者。其它包括放化疗、靶向治疗、嵌合抗原受体T细胞(CAR-T)治疗和免疫治疗在内的临床疗法,均存在疗效与获益群体有限及毒副作用大等缺陷。
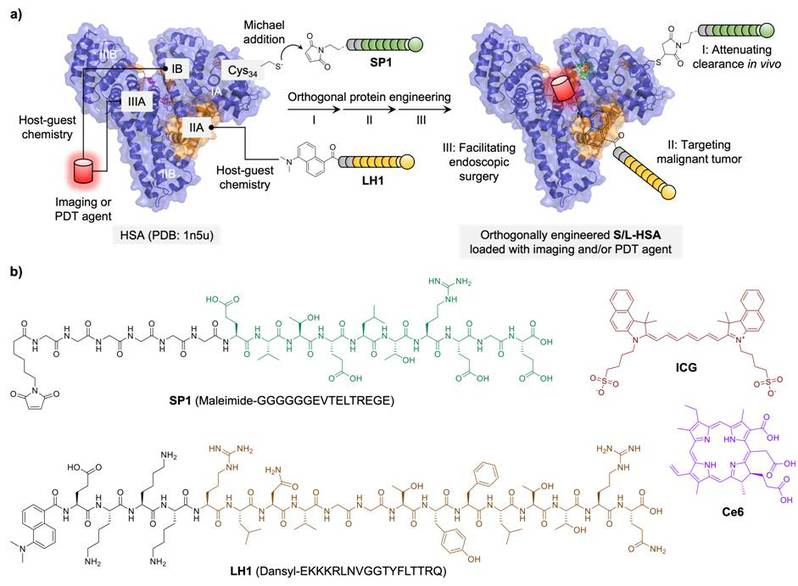
磷脂酰肌醇蛋白聚糖3(GPC-3)是一种跨膜表达的硫酸乙酰肝素蛋白多糖,参与调控个体发育、细胞增殖和分化等过程。王红阳院士团队率先发现GPC-3是HCC的高特异性肿瘤标志物,在病理组织上的阳性率高达90%;此外,靶向GPC-3的CAR-T疗法也已于近期取得了临床进展。基于上述基础,研究团队开发了一种基于人血清白蛋白(HSA)正交修饰的化学策略,实现了GPC-3靶向的HCC诊疗。
HSA是一种FDA批准用于临床的高生物相容性药物载体,然而天然HSA易被肝脏吸收,降低了其所负载药物的肿瘤靶向性。此外,常规药物载体到达肿瘤部位前,往往易被体内免疫系统清除。前期研究表明,整合素相关蛋白CD47在多种癌细胞中过表达,其可与巨噬细胞表面的SIRPα(信号调节蛋白-α)相互作用,从而激活“别吃我”信号,使癌细胞逃逸免疫清除。
基于此,本研究工作提出了一种对HSA单体共价与非共价化学结合的“正交”修饰策略,以1:1的摩尔比在HSA上定量引入两种不同功能的多肽,一种靶向原发性肝细胞癌(HCC),另一种模拟免疫检查点信号从而沉默巨噬细胞吞噬,通过SAXS结合Alphafold2解析了蛋白质修饰结构。有趣的是,该修饰策略不干扰HSA结合其它功能分子的结构域构象,从而进一步实现了FDA批准临床使用的近红外荧光造影剂ICG及/或光动力试剂Ce6的协同负载。最终,通过系列动物水平实验验证了其对HCC实体瘤的体内靶向、长效荧光可视化及光驱动消融性能,为基于内源性蛋白质的结构可控多功能修饰提供了新的化学正交策略,同时为HCC的腹腔镜下术中荧光导航与光驱动治疗提供了靶向特异性的新试剂原型。
化学与分子工程学院博士后出站人员豆伟涛(现为华东师范大学专任副研究员)为本文第一作者,生物学实验由硕士毕业生邱鹏、博士研究生郭宸等协作完成,美国德克萨斯大学奥斯汀分校Jonathan L. Sessler教授,海军军医大学附属上海东方肝胆外科医院王红阳院士、谈冶雄研究员,中科院上海药物研究所李佳研究员和贺晓鹏教授为论文共同通讯作者,研究工作得到了田禾院士的悉心指导。小角度散射实验得到了蛋白质科学研究(上海)设施五线六站(BL19U2)李娜博士的指导与支持,计算模拟实验由上海科技大学刘婷婷博士完成,并得到了赵素文研究员的指导。本研究获得了国家自然科学基金委医学部重大研究计划“肿瘤演进与诊疗的分子功能可视化研究”、化学部重大研究计划“生物大分子动态修饰与化学干预”和材料生物学与动态化学教育部前沿科学中心、上海市科技重大专项、费林加诺贝尔奖科学家联合研究中心等资助。
原文链接:https://pubs.acs.org/doi/ 10.1021/jacs.3c05052
