近日,我校化学与分子工程学院特聘副研究员张志伟与青岛大学董铭心教授、加拿大多伦多大学Andrew Woolley教授等合作,在生物活性光开关分子光药理学应用领域取得重要突破,相关成果以“Isomerization of bioactive acylhydrazones triggered by light or thiols”为题在线发表于国际期刊Nature Chemisty(IF: 21.8)上。
光药理学(photopharmacology)是近年来一种新兴的医疗方法。通过光照控制药物活性,可以有效避免传统药物副作用大、环境毒性高、易产生抗药性等弊端,从而提升药物选择性,实现精准诊疗。如何开发简便高效的光控药物设计通用策略是该领域目前面临的重大挑战之一。研究者发现,酰腙席夫碱光开关分子是多种抑制剂等药物的骨架结构,然而其不同异构体的药物活性却鲜有研究。在该工作中,研究者成功筛选出不同种类的酰腙席夫碱药物分子并对其异构体的药物活性进行了系统探究,成功证明酰腙席夫碱自身可以作为光控药物,且生物相容性佳,满足原位光控应用需求,为光药理学发展提供分子基础。
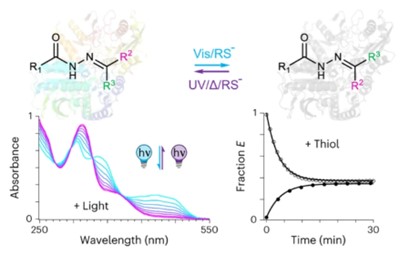
光控药物普遍适用性。酰腙席夫碱药物217/43是N-甲基-D-天冬氨酸受体(NMDAR)的正向变构调节剂,是治疗精神性疾病的潜在药物。该类分子离子化后呈现出高效的可见光驱动光开关过程。顺式异构体较反式构型半数效应浓度(EC50)由80 nM下降至5.3 μM,异构体活性差异高达近70倍。药物分子3DHO、5TUS及3T7P展现出类似的光异构化性能及异构体活性差异,证明酰腙席夫碱光开关分子作为光控药物具有普遍适用性。
良好的生物相容性。研究人员发现该类药物分子可以在人胚胎肾细胞(HEK293)内发生高效的可见光光开关过程。可见光/热驰豫过程可以在细胞环境下经历数次循环而并未检测到明显衰减。研究人员还发现,酰腙席夫碱分子异构化过程还可以被谷胱甘肽(GSH)等硫醇分子催化,且催化平衡态与异构体初始状态无关。光照/硫醇正交调控特性可以有效扩宽酰腙席夫碱药物分子实际应用场景。
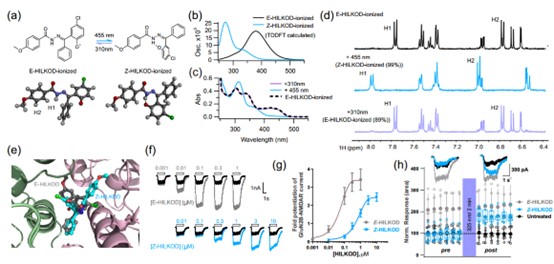
细胞内原位光控。针对细胞环境下现有光控药物分子半衰期缩短,细胞层面原位光控应用受限这一难题,研究人员成功筛选出药物分子HILKOD。由于存在交叉共轭,异构体吸收波长实现分离,异构化过程因此可以分别使用蓝光/紫外光驱动。研究者利用该光控药物分子首次在细胞中实现对N-甲基-D-天冬氨酸受体活性的原位光控,为光控药物活体应用打下坚实基础,展现出广阔的光药理学应用前景。
化学与分子工程学院特聘副研究员张志伟、多伦多大学博士生Giang N.T.Le以及不列颠哥伦比亚大学博士生Yang Ge(葛洋)为该工作共同第一作者,不列颠哥伦比亚大学Peter Axerio-Cilies博士、Yutian Wang(王玉田)教授、青岛大学董铭心教授以及多伦多大学Andrew Woolley教授为论文的共同通讯作者。研究工作同时得到了化学与分子工程学院田禾院士、张隽佶教授的大力支持与指导。该研究工作得到了国家自然科学基金青年基金、中国博士后科学基金、上海市超级博士后激励计划等资助。
原文链接:https://www.nature.com/articles/s41557-023-01239-5
