近日,我校生物反应器工程国家重点实验室叶邦策教授课题组在DNA纳米系统的设计及生物医学应用研究中取得了突破性进展,相关研究成果以“Nano-Biohybrid DNA Engager That Reprograms the T‑Cell Receptor”为题,发表在国际权威期刊《美国化学会志》上(J. Am. Chem. Soc., 2022, doi:10.1021/jacs.2c05903)。
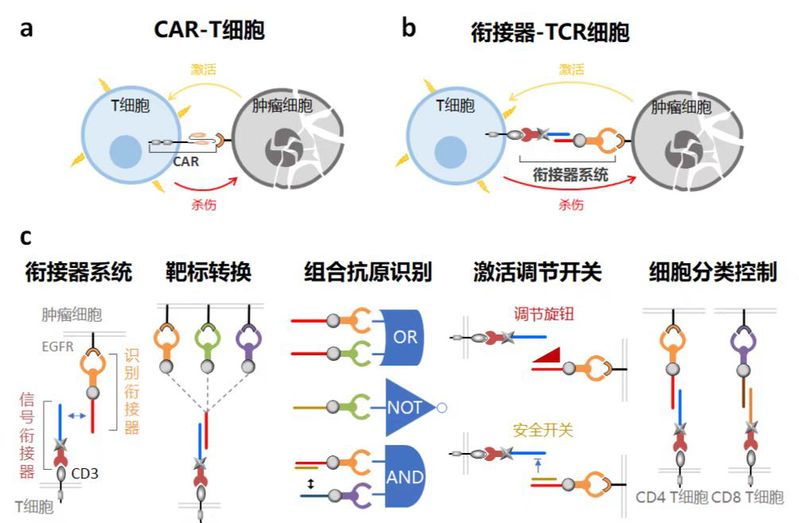
近些年,CAR-T细胞疗法通过基因工程表达嵌合抗原受体于T细胞表面,实现对肿瘤的特异性杀伤,成为极具前景的肿瘤治疗手段(图a)。但CAR-T疗法依然存在基因插入潜在风险,脱靶毒性(靶向特异性)和细胞因子风暴(响应强度)等问题,该工作构建了T细胞膜上的DNA生物纳米杂合衔接系统应用于工程化改造T细胞实现肿瘤免疫治疗,通过在细胞膜水平重编程T细胞受体,赋予其对肿瘤抗原的特异性识别及肿瘤细胞的特异性杀伤能力(图b)。该衔接系统通过模块组件快速组装,实现靶向性快速转换,降低改造成本,增强疗法的通用性;利用DNA链置换反应的灵活性和可设计性,完成多种抗原的组合识别,提高疗法的识别特异性,同时构筑激活调节开关,实现T细胞可控激活,防范细胞因子风暴等副反应;设计正交衔接组合,实现对不同类型T细胞的分类控制,提高疗效(图c)。荷瘤小鼠模型测试实验评估了衔接系统改造的T细胞临床应用潜力。本研究创新性地利用DNA纳米衔接装置改造T细胞表面天然受体,实现了对肿瘤抗原的特异性识别,规避了基因工程手段的潜在风险,改善了T细胞疗法适用性、安全性和有效性。
近年来,叶邦策教授和尹斌成教授在DNA分子机器设计及生物传感应用领域取得了一系列研究成果,为DNA分子机器在活细胞内高效的信号转换、基因调控网络重构及调节提供了新理念,拓展了其在生命科学的基础研究及生物医药应用。以DNA组件间可编程杂交反应的熵变或细胞内源分子作为驱动力,实现了DNA分子在纳米粒子表面的高效自动行走,比传统静态的复合物模式提高了3个数量级,应用于活细胞miRNA及其诱导的沉默复合体(miRISC)活力的高灵敏成像、核酸药物可控释放及复杂免疫反应过程的模拟(Angew. Chem. Int. Ed., 56, 9077, 2017;Chem. Sci., 9, 3299, 2018;J. Am. Chem. Soc., 142, 3851, 2020; Talanta, 215, 120898,2020;ACS Appl. Bio Mater., 3, 2861-2866, 2020; Biosens. Bioelectron.,220, 114828, 2023)。
该研究工作由博士后马培强、博士生刘天贤和李华栋完成,通讯作者为叶邦策教授、尹斌成教授。该研究得到了国家重点研发计划、国家自然科学基金、上海市“曙光计划”等项目资金支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/jacs.2c05903
